Уральские ученые совместно с иностранными
коллегами нашли способ упростить вычисления при компьютерном моделировании механики
сердца. Сокращение времени и компьютерной мощности, требуемой для расчетов, приближает
возможность применения этих моделей для диагностики и лечения пациентов в
клиниках. Статья опубликована в журнале PLOS One. Исследования поддержаны грантом
Российского научного фонда.
Во время
сердечного цикла происходит синхронное сокращение двух предсердий, затем
–желудочков, а потом расслабление. Здоровый орган работает в определенном
ритме, но практически все его заболевания приводят к сбоям. Из-за этого наш
«внутренний насос» утрачивает способность перекачивать кровь в нужном объеме и
развивается хроническая сердечная недостаточность. Она сопровождается постоянной
усталостью, одышкой, отеками ног и нарушением работы органов – легких, печени,
почек, так как организм не получает необходимое количество кислорода. Начинаются
застои крови. Несмотря на широкий спектр существующих методов лечения, хроническая
сердечная недостаточность остается одной из ведущих причин смерти во всем мире.
В России каждую минуту от нее погибает в среднем один человек.
Более детальное
описание работы сердца в норме и при поражениях помогает ученым повышать
эффективность существующих методов лечения и разрабатывать новые. Один из
подходов – интеллектуальное моделирование – позволяет создавать численные
модели, описывающие свойства и работу сердца. Эти вычисления можно использовать
как аналитический инструмент, применимый в медицинской практике и при
клинических испытаниях.
Сначала
проводят расчеты на детализированных моделях сердца с большим количеством
варьируемых параметров сердечной мышцы (миокарда), таких как проводимость и
сократимость. Получаются «виртуальные клинические данные», которые можно
сравнить с реальными результатами клинических исследований – ЭКГ, УЗИ и других.
Среди них отбирают те, что попадают в диапазоны наблюдаемых показателей для
определенной группы пациентов. Затем при помощи машинного обучения находят
зависимости между результатами модели и ее параметрами, таким образом получая
значения, которые наиболее близки к показателям пациентов. Имея такие
взаимосвязи, становится возможно оценить состояние сердца конкретного пациента.
Однако существующие модели требуют слишком сложных расчетов и неприменимы для повседневного
использования, поэтому перед исследователями стоит задача их упрощения.
Ученые из Института
иммунологии и физиологии УрО РАН (ИИФ УрО РАН) и Уральского федерального
университета имени первого Президента России Б. Н. Ельцина (УрФУ) разработали
новую стратегию уменьшения вычислительной сложности, необходимой для построения
таких моделей. Ученые установили, как в течение сократительного цикла
изменяется объем желудочка в зависимости от изменения длины одного мышечного
элемента сердца. В случае последнего расчеты сделать гораздо проще, чем для 3D-модели целой камеры сердца.
Это позволило использовать модель более низкого порядка для вычисления
сократительной функции желудочка и получить результат нужной точности с
меньшими затратами на обучение программы.
«Наш подход
основан на хорошо установленных данных о сходстве сокращения изолированной
мышцы и всего желудочка. В частности, мы демонстрируем, что простых линейных
преобразований между растяжением мышцы и сокращением объема камеры достаточно
для воспроизведения общих выходных данных давления и объема в 3D-моделях. Мы разрабатываем
процедуру обучения стартовой конечно-элементной модели с повышением ее точности
и приводим пример оптимизации параметров на основе медицинских изображений», – комментирует
Ольга
Соловьева, доктор физико-математических наук, профессор, заведующий лабораторией
математической физиологии в ИИФ УрО РАН и лабораторией «Математическое
моделирование в физиологии и медицине с использованием суперкомпьютерных
технологий» УрФУ.
Описание
работы желудочка позволяет решать новые задачи, связанные с током крови,
давлением и другими аспектами работы сердца. Используя предложенный подход,
можно анализировать большие массивы данных реальных клинических исследований и
выводить общие закономерности, применимые в медицинской практике. Биофизические
модели, учитывающие особенности конкретного пациента, могут быть полезны для
увеличения эффективности подбора лекарств или при сердечной ресинхронизирующей
терапии – установке кардиостимулятора, электроды которого контролируют работу
сердца и помогают его камерам сокращаться в нужном ритме.
Исследования
проводились совместно с коллегами из исследовательского центра IBM имени Томаса
Джона Уотсона (Йорктаун Хайтс, штат Нью-Йорк).

Картинка 1.
Вячеслав Гурьев, один из авторов исследования, ведущий научный сотрудник группы
по многомасштабным биологическим системам и моделированию исследовательского
центра имени Томаса Дж. Уотсона IBM, Нью Йорк. Источник: Илья Сафаров/Фотоклуб
УрФУ.
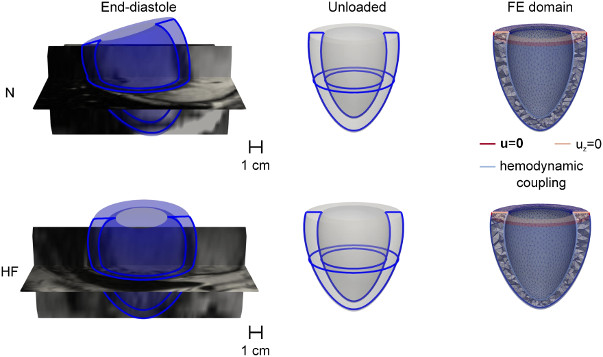
Картинка 2. N – нормальное сердце, HF – сердечная
недостаточность. Источник: Paolo Di Achille et al. / PLOS One,
2020.