Ученые описали пространственную
структуру белка OmhA, который помогает бактериям, живущим при высоких
температурах и в отсутствие кислорода, получать энергию в результате
внеклеточного переноса электронов на нерастворимые минеральные соединения
железа. Белок состоит из двух частей, одна из которых отвечает за перенос
электронов, а вторая – обеспечивает закрепление OmhA в бактериальной оболочке.
Микроорганизмы активно участвуют в преобразовании разных форм железа, в том
числе, в формировании минеральных пластов. Таким образом, полученные данные
расширяют представления о формировании горных пород и, в частности, круговороте
железа в природе. Результаты исследования, поддержанного грантом
Российского научного фонда и выполняемого в рамках национального проекта «Наука и
университеты», опубликованы в журнале Structure.
Дыхание – это процесс, благодаря которому клетки
получают энергию. В дыхательном процессе участвуют белковые комплексы,
формирующие дыхательную цепь, по которой передаются электроны. Конечным
акцептором электронов у растений, животных и многих микроорганизмов служит
кислород. Именно поэтому мы не можем жить в его отсутствие. Однако существуют
бактерии, обитающие в бескислородных средах. Эти микроорганизмы в качестве
акцептора электронов могут использовать окисленные соединения серы, азота, а
также нерастворимые оксиды металлов, находящиеся во внеклеточном пространстве.
Перенос электронов на нерастворимые оксиды металлов в дыхательных процессах
называется бактериальной металлоредукцией. Наиболее распространенным является
процесс бактериальной железоредукции, где акцепторами электронов являются
минеральные формы оксидов железа, такие как ферригидрит, гематит, гетит. Таким
образом, бактерии активно участвуют в формировании каменной оболочки планеты.
Ключевую роль в переносе электронов от клетки на
внеклеточный акцептор или между двумя клетками выполняют мультигемовые
цитохромы – белковые молекулы, содержащие от 4 до 25 и более гемов –
железосодержащих комплексов, которые отвечают за перенос электронов. К
настоящему моменту известно множество бактериальных цитохромов, участвующих во
внеклеточном транспорте электронов. Структура и механизм их работы зависит от
строения бактериальной стенки и природы акцептора.
Ученые из ФИЦ Биотехнологии РАН (Москва) описали
свойства и пространственную структуру 11-гемового цитохрома OmhA из
бактерии Carboxydothermus ferrireducens, которая
обитает в богатых железом горячих источниках и использует нерастворимые
соединения железа в качестве акцепторов электронов в дыхательных процессах.
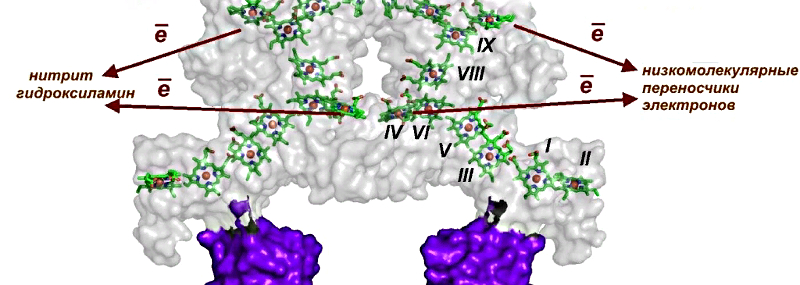
Авторы показали, что молекула OmhA является димером,
в котором каждый мономер состоит из двух доменов, один из которых, содержащий
все 11 гемов, отвечает за перенос электронов из клетки через внеклеточное
пространство на нерастворимый акцептор – ферригидрит. Помимо переноса
электронов на ферригидрит, OmhA может переносить электроны на нитрит и
гидроксиламин, а также на растворимые низкомолекулярные переносчики флавиновой
природы. Широкий круг используемых акцепторов может расширять адаптационный
потенциал бактерии в условиях изменения среды обитания. Анализ пространственной
структуры позволил выделить несколько групп гемов, в том числе гемы, отвечающие
за вход электронов в электрон-транспортную цепь, гемы, формирующие электрон-транспортную
цепь, и гемы, отвечающие за взаимодействие и перенос электронов на акцепторы.
Второй домен имеет строение, похожее на строение
белков, формирующих специальный белковый слой на внешней поверхности клетки,
отвечающий за связывание и распределение функционально важных внеклеточных
белков. Встраивание этого домена в белковый слой обеспечивает закрепление и
функционально правильное расположение электрон-транспортной цепи первого домена
относительно других белков – доноров электронов в клетке бактерии. Таким
образом, авторам удалось охарактеризовать цепь переноса электронов от
поверхности клетки к внеклеточному акцептору.
«Нам удалось установить пространственное
строение одного из основных белков экстраклеточного электронного транспорта
термофильной бактерии Carboxydothermus ferrireducens, а также установить
механизмы связывания этого белка с поверхностью клетки и поверхностью
минеральной формы акцептора электронов – ферригидрита», – рассказывает
заведующий лабораторией инженерной энзимологии, научный руководитель ФИЦ
Биотехнологии РАН, академик В. О. Попов.
Источники: ФИЦ Биотехнологии РАН,
научно-информационный портал «Поиск».