http://93.174.130.82/news/shownews.aspx?id=876fb7c7-be8f-4bb9-a1f3-0a9af692007a&print=1
© 2025 Российская академия наук
В Институте химической биологии и фундаментальной медицины СО РАН изучили уникальный фермент репарации, который способен напрямую удалять повреждения и восстанавливать структуру нуклеотидов ДНК и РНК без помощи других ферментов. Полученные данные могут быть использованы для разработки противоопухолевых лекарственных препаратов, а также подбора персонализированного лечения заболеваний, связанных с повреждением геномной ДНК. Результаты работы опубликованы в International Journal of Molecular Sciences.
Фермент, находящийся в центре внимания учёных, имеет сложный механизм действия и не до конца ясно, как он взаимодействует со своей ДНК-мишенью. Пользуясь комбинацией биохимических и биофизических методов, учёные впервые исследовали структурную динамику фермента ALKBH3 в растворе. Им удалось выявить ключевые аминокислотные остатки (главные компоненты белков), взаимодействующие с ДНК, охарактеризовать их роль в ферментативном процессе, и установить, как влияет их удаление на динамику структуры всего белка.
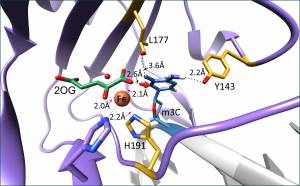
Изображение: активный центр диоксигеназы ALKBH3, связанной с поврежденной ДНК
В дальнейшем полученные данные могут быть использованы для разработки лекарственных препаратов, направленных на подавление нежелательной активности фермента ALKBH3 в клетках злокачественных опухолей. Также они находят применение в персонализированной медицине, так как могут быть использованы в определении активности этого фермента в живой клетке. Если мы знаем уровень активности ферментов репарации у конкретного человека, то можем давать прогноз о развитии тех или иных патологий, связанных с повреждением геномной ДНК.
«Информацию о контактах между ферментом и повреждённой ДНК-мишенью обычно получают методом рентгеноструктурного анализа кристаллов белка. Такие кристаллы зачастую невозможно получить для структурно подвижных ферментов содержащих слабо упорядоченные домены, каким и является диоксигеназа ALKBH3. Мы впервые показали, что снижение реакционной активности мутантных (искусственно изменённых) форм диоксигеназы напрямую связано понижением количества бета-складок и увеличением доли альфа-спиралей в структуре», — рассказывает Любовь Канажевская, научный сотрудник Центра масс-спектрометрического анализа ИХБФМ СО РАН, руководитель гранта РНФ No 22-24-00699. Исследование новосибирских ученых даёт новую перспективу для изучения пространственной организации фермента ALKBH3, который не удаётся закристаллизовать связанным с ДНК-мишенью. Полученные учёными данные помогают лучше понять, как реализуются механизмы защиты нашей наследственной информации.
Источник: «Поиск».