Туберкулёз (ТБ) — опасное инфекционное заболевание человека, поэтому создание новых инструментов для его эпидемиологического контроля по-прежнему не теряет своей актуальности. В последние годы ТБ представляет особую опасность для пациентов, инфицированных вирусом иммунодефицита человека (ВИЧ) и коронавирусом SARS-CoV-2, что обуславливает востребованность быстрых и адаптированных к массовому скринингу способов идентификации вариантов Mycobacterium tuberculosis (МТБ), представляющих опасность для человека.
В отчёте Всемирной организации здравоохранения (ВОЗ) за 2021 г. представлены данные об увеличении смертности от ТБ в связи с пандемией COVID-19 до показателей 2017 г. ТБ стал причиной смерти 1.6 млн человек в 2021 г., включая 187 тыс. ВИЧ-инфицированных пациентов. Дальнейшее распространение ТБ зависит от эффективности мер, направленных на повышение качества и доступности его диагностики. Перспективной платформой для создания быстрых способов диагностики микобактериальной инфекции стал метод петлевой изотермической амплификации (от англ. loop-mediated isothermal amplification, LAMP). Механизм реакции LAMP предполагает проведение амплификации ДНК при постоянной температуре ~65°C с помощью ДНК-полимеразы, обладающей цепь-вытесняющей активностью, а также “коровых” (внутренних и внешних) и петлевых праймеров для ускорения реакции. На основе метода LAMP его авторами разработана новая автоматизированная система “Simprova” для быстрой пробоподготовки и мультиплексной детекции патогенов, позволяющая проводить стадию амплификации за 15–20 мин в микрочипах особой архитектуры.
Большинство существующих тест-систем для идентификации M. tuberculosis методом LAMP основано на амплификации фрагментов генов домашнего хозяйства и/или последовательности мобильного генетического элемента (МГЭ) IS6110. Тем не менее уже ~20 лет назад на территории стран с высоким бременем ТБ, таких как Вьетнам, Индия, Ирак и Либерия, стали обнаруживаться штаммы M. tuberculosis, не имеющие ни одной копии IS6110. Долгое время именно последовательность IS6110 считалась наиболее подходящей мишенью для дифференциальной диагностики МТБ, и она продолжает использоваться до сих пор. Это связано с тем, что в геноме микобактерий последовательности IS1081 и IS6110 могут присутствовать в нескольких копиях, поэтому они применяются для увеличения аналитической и клинической чувствительности тест-систем. На свойстве многокопийности этих МГЭ основан принцип работы тест-систем, одобренных ВОЗ, однако в них МГЭ используются в качестве дополнительных мишеней.
Цель настоящей работы — разработка быстрой и чувствительной тест-системы ТБ-ИЗАТЕСТ на основе метода LAMP для количественной диагностики бактерий вида M. tuberculosis. В ходе работы проводился скрининг однокопийных мишеней в геноме микобактерий целевого вида, нуклеотидная последовательность и GC-состав которых совместимы с требованиями к дизайну праймеров для изотермической амплификации. Особое внимание уделялось оптимизации условий проведения реакции, подбору концентраций основных компонентов реакционной смеси, а также измерению аналитических характеристик тест-системы.
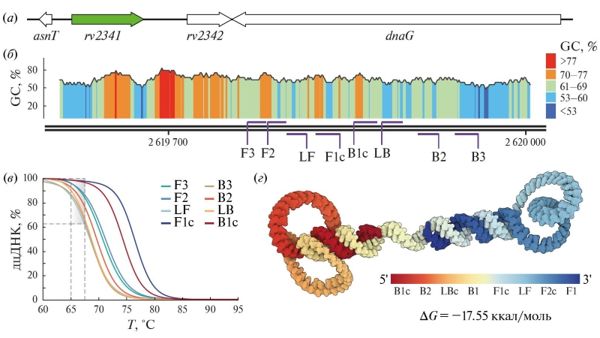
Рис. 1. Характеристика гена-мишени rv2341 и набора праймеров TB2341. (а) Карта расположения мишени в геноме типового штамма M. tuberculosis H37Rv. (б) Диаграмма распределения GC-состава нуклеотидной последовательности rv2341. Схематично показано расположение сайтов отжига праймеров. (в) Моделирование кривых плавления двуцепочечной ДНК (дцДНК) в сайтах отжига праймеров при различных температурах. Пунктиром выделен исследованный температурный диапазон активности Bst-ДНК-полимеразы (65–67°C), демонстрирующий динамику и синхронность гибридизации праймеров с геном-мишенью. Сайты отжига F1c/B1c обладают повышенной Тпл, необходимой для стабильности одноцепочечных петель стартового ампликона. (г) Молекулярная модель стартового ампликона, теоретически существующая при оптимальных условиях реакции LAMP. Одноцепочечные петли позволяют праймерам отжигаться при изотермических условиях без необходимости термической денатурации ДНК. Цветовым градиентом показано расположение различных сайтов отжига и их комплементарных участков. Длина стартового ампликона – 185 нт, GC-состав – 65%
Ген rv2341 использовался ранее при создании ПЦР-праймеров, но не применялся для тест-систем на основе LAMP, поэтому он был выбран в качестве мишени в данной работе (рис. 1а–б). При выборе гена принимали во внимание консервативность его нуклеотидной последовательности среди штаммов M. tuberculosis. Важная роль rv2341 в физиологии микобактерий и его локализация вблизи гена Asn-тРНК (asnT), предполагающие низкую вероятность делеции такого локуса, а также высокая аналитическая специфичность упомянутых выше ПЦР-праймеров служили дополнительными факторами в пользу выбора этого гена.
По результатам in silico анализа ген rv2341 и соответствующий набор праймеров TB2341 удовлетворяли условиям реакции LAMP. Данные праймеры слабо подвержены образованию нежелательных димеров, имеют однородную температуру отжига (рис. 1в), гибридизуются с участками гена-мишени без стабильных вторичных структур. При этом стартовые гантелеобразные ампликоны в тех же условиях формируют более стабильные одноцепочечные петли, что следует из меньшего значения свободной энергии Гиббса ампликона (рис. 1г) в сравнении с термодинамической стабильностью шпилек в составе гена-мишени.
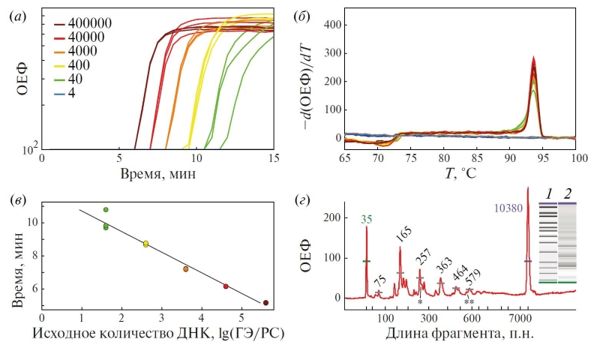
Рис. 2. Характеристики реакции LAMP на основе полного набора праймеров TB2341 при оптимальных условиях амплификации. (а) – Кривые амплификации в логарифмическом масштабе при измерении аналитической чувствительности в диапазоне концентраций 4 × 100–4 × 105 геном-эквивалентов M. tuberculosis. Предел детекции – 4 × 101 копий геномной ДНК на реакцию; (б) – кривые плавления финального амплификата; (в) – стандартная кривая с визуализацией линейного динамического диапазона. Эффективность амплификации – 152.4% (R2 = 0.977). ГЭ – геном-эквивалент; РС – реакционная смесь; (г) – визуализация продуктов реакции с помощью капиллярного электрофореза: 1 – маркер молекулярных масс ДНК (снизу вверх: 35, 50, 100, 150, 200, 300, 400, 500, 600, 700, 1000, 2000, 3000, 7000, 10 380 п.н.); 2 – продукты амплификации в виде характерной периодичной “лесенки”. Приведены значения молекулярной массы продуктов с наибольшей концентрацией. Рассчитанные молекулярные массы ампликонов имеют следующие значения: 165, 268*, 361, 464, 557** п.н. Звездочками на рисунке обозначены соответствующие минорные пики: * 267 п.н.; ** 552 п.н.
Пандемия коронавирусной инфекции наглядно продемонстрировала последствия низкой пропускной способности диагностических лабораторий, ограниченных рамками существующих методических рекомендаций и тест-систем на основе ПЦР. К сожалению, многие диагностические центры оказались неадаптированными к массовому скринингу. Более того, большой ущерб был нанесен диагностике других инфекционных заболеваний, среди которых оказался и ТБ. Один из способов решения этой проблемы заключается в более широком внедрении быстрых тестов на основе метода LAMP, применение которых возможно не только в крупных городах, но и в регионах.
В настоящей работе впервые для метода LAMP был применен комплексный подход к подбору гена-мишени, дизайну праймеров и анализу их физико-химических свойств, а также к выбору стратегии оптимизации концентраций компонентов реакционной смеси и условий амплификации, основанной на методе ортогональных матриц Тагути, с последующим дисперсионным анализом полученных экспериментальных данных.
Важное преимущество метода LAMP заключается в возможности сокращения длительности стадии амплификации, которая обычно составляет 30–60 мин. Поэтому большое внимание было уделено оценке ландшафта оптимальных значений таких факторов, как температура инкубации, а также концентрация ионов магния и dNTP. Двухстадийный TMN-протокол оптимизации по методу Тагути и комплексный статистический анализ данных позволили небольшим количеством экспериментов добиться максимальных показателей эффективности амплификации. Так, важным результатом оптимизации стало сокращение длительности стадии амплификации до 15 мин. Этого времени оказалось достаточно для обнаружения 40 копий геномной ДНК M. tuberculosis на реакцию.
Разработанная тест-система ТБ-ИЗАТЕСТ может найти применение в различных областях исследований возбудителя ТБ. Наиболее вдохновляющим возможным примером применения разработанной тест-системы представляется ее использование для быстрой оценки эффективности схемы антибактериальной химиотерапии, назначаемой пациенту с ТБ. Высокая скорость амплификации в сочетании с количественным анализом геномной ДНК M. tuberculosis позволяют повысить регулярность контроля эффекта принимаемых препаратов, что недоступно при методе культивирования. При использовании однокопийной мишени rv2341 выявляемое количество геном-эквивалентов будет соответствовать количеству клеток микобактерий. Проблема дифференциации геномной ДНК живых и мертвых клеток при этом характерна для всех методов амплификации и, следовательно, не будет недостатком предлагаемой тест-системы.
В заключение необходимо отметить, что представленные результаты в значительной степени пионерские. Многие аспекты экспериментов с LAMP раскрыты в соответствии с руководящими принципами MIQE, разработанными для стандартизации результатов количественной ПЦР. В частности, в совокупности с результатами более ранних работ можно утверждать, что диапазон значений эффективности амплификации LAMP для оптимизированных тест-систем лежит в пределах 99–152%, что существенно превосходит метод ПЦР.
Ранее в журнале Russian Journal of Bioorganic Chemistry был опубликован обзор метода LAMP: Loop-Mediated Isothermal Amplification: From Theory to Practice.
Текст: Артём Григоров.
Источник: ИБХ РАН.