http://93.174.130.82/news/shownews.aspx?id=6adff780-7c3d-4505-b512-51c54d786d8f&print=1
© 2025 Российская академия наук
В лаборатории химии технеция и лаборатории анализа радиоактивных материалов Института физической химии и электрохимии им. А.Н. Фрумкина РАН синтезировали и изучили перренат и пертехнетат гистидиния — соединения тетраоксидоаниона рения или технеция с гистидиновой аминокислотой. Для технеция это второе известное соединение с такой аминокислотой.
Выяснилось, что в обоих случаях образовывается трёхзарядный молекулярный ион. Для соединения рения обнаружен новый подтип анион-анионного взаимодействия между карбоксилатной группой гистидиния и атомом рения в составе перренат-аниона. Результаты опубликованы в высокорейтинговом журнале Королевского химического общества (RSC) CrystEngComm.
Рентгеноструктурный анализ синтезированных соединений продемонстрировал сложную систему водородных связей, которые могут поддерживать стабильность молекул. В экспериментах с рением и технецием использовался один и тот же изомер гистидина, присутствующий в человеческом организме. Однако полученные структуры для рения и технеция различаются не только количеством независимых фрагментов, но и взаимодействиями в них.
Если в пертехнетате образуется больше водородных связей типа N–H···O, то в перренате наблюдается большее разнообразие нековалентных взаимодействий (взаимодействие пары «углерод-водород» с электронным облаком ароматического кольца, анион-анионные взаимодействия). В перренате гистидиния обнаружен новый тип анионного взаимодействия C–O···Re. Атом кислорода из карбоксилатной группы взаимодействует с атомом рения. Расстояние между ними составляет 2,97 Å. Это что достаточно мало; обычно расстояние между атомами при таких взаимодействиях составляют не менее 3,10 Å.
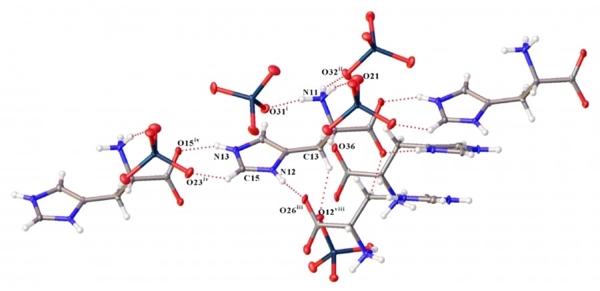
Система водородных связей
«В этой работе мы впервые описали анион-анионное взаимодействие атома рения с атомом кислорода из карбоксилатной группы, — отметил один из авторов работы младший научный сотрудник лаборатории анализа радиоактивных материалов ИФХЭ РАН Антон Новиков. — Оно может представлять интерес для изучения процессов самоорганизации структур и процессов самосборки. Подобное взаимодействие было найдено в некоторых соединениях марганца и рения, но не обнаружено для технеция. Возможно, всё ещё впереди, потому что для технеция синтезировано и описано не многим более 1000 структур, в то время как для марганца и рения их более на порядки больше. Но может быть, для технеция такие взаимодействия не свойственны. Для выяснения природы этого факта требуются дальнейшие исследования».
Молекула гистидина обычно существует в цвиттер-ионой форме. Это значит, что в целом она является электронейтральной, но в ее структуре присутствуют функциональные группы, несущие как отрицательный, так и положительный заряды. В ходе изучаемых реакций к имидазольному кольцу гистидина присоединился протон, и гистидин стал положительно заряженным ионом — катионом гистидиния с пространственно-разделёнными зарядами: два положительных заряда на амино-группах и один отрицательный на карбоксилатной.
«Для электронейтральной молекулы с тремя заряженными участками мы предложили название «дриттер-ион», от немецкого слова drei — три, — пояснил Антон Новиков, — так же, как молекула с двумя заряженными участками называется цвиттер — ион, от слова zwei — два».
Анализ нековалентных взаимодействий в перренатах, пертехнетатах и их аналогах с гистидинием, проведенный методом поверхности Хиршфельда показал, что наиболее важный вклад в организацию упаковки (связывание молекул в структуру) вносит взаимодействие O···H/H···O для катионов и анионов, то есть водородные связи.
Принято считать, что рений и технеций имеют похожие химические свойства, геометрия перренатов и пертехнетатов одинаковая, и свойства радиоактивного технеция можно изучать, экстраполируя результаты экспериментов с не требующим специальных условий рением. Ряд научных работ, однако, свидетельствуют, что эти два элемента из 7 группы побочной подгруппы таблицы Менделеева все-таки ведут себя по-разному.
Данная работа показывает, что соединения технеция и рения с гистидинием неизоструктурны, что ещё раз подчёркивает значение слабых нековалентных связей и важность изучения соединений технеция на ряду с соединениями рения.
«Кристаллизация перрената и пертехнетата с одним и тем же катионом в разных пространственных группах, по нашим наблюдениям, связана не с кислотностью раствора (соединения получали из кислот и солей соответствующих металлов), а с большей диффузионной способностью 5-d орбитали рения по сравнению с 4-d-орбиталью технеция. Все дело в распределении электронной плотности в молекуле. Как обнаружено в нашей работе, в соединении рения образовались дополнительные слабые карбоксилат-перренатные связи, которые вызвали изменение пространственной группы. На атоме рения образуется частично положительный заряд или, как это принято говорить, σ-дырка, в то время как к нему ориентируется избыточная электронная плотность атома кислорода. — объяснил Антон Новиков. — Этот результат указывает на важность образования слабых связей для структуры образующихся соединений, даже с идентичной брутто-формулой, и открывает возможность разделения близких элементов (таких как Tc и Re)».
Для развития современной химии большое значение имеют особые физические и химические свойства молекул, такие как люминесценция, растворимость в различных растворителях, температура и тип фазового перехода. Эти свойства соединений определяются водородными и слабыми нековалентными меж- и внутримолекулярными взаимодействиями. Анализ нековалентных взаимодействий в соединениях металлов и биоорганических молекулах позволяет получить новую информацию о процессах молекулярного распознавания, рецепторно-информационных цепях, влиянии кофакторов и помогает интерпретировать процессы межмолекулярного переноса энергии. Слабые нековалентные взаимодействия имеют большое значение в биологии; они вовлечены в механизм связывания активного центра с субстратом и регуляции сродства к кислороду. Они влияют на трёхмерную форму ДНК.
Соли тетраоксидоанионов элементов седьмой группы побочной подруппы — перренаты и пертехнетаты — одни из наиболее интересных классов соединений, представляющих широкие возможности для анализа нековалентных взаимодействий. В таких соединениях на один атом металла приходятся четыре атома кислорода, расположенные в вершинах тетраэдра. Одиночный отрицательный заряд формально распределяется между ними поровну. Таким образом образуются слабые, но многочисленные водородные связи. Перренаты и пертехнетаты используются в ядерной медицине, как для диагностики, так и для лечения онкологических заболеваний.
Гистидин — одна из незаменимых аминокислот, которая участвует в клеточном метаболизме и входит в состав активных центров множества ферментов. В организме из гистидина образуется гистамин. Гистидин входит в состав гемоглобина. Он необходим для синтеза в организме карнозина и ансерина — веществ, способствующих восстановлению мышц. Гистидин входит в состав некоторых витаминных комплексов и медицинских препаратов. В случае эффективного связывания гистидина с отрицательными анионами ReO4– или TcO4–, такие соединения могут быть перспективными поставщиками рения и технеция в клетки органов и тканей. Исследование новых соединений гистидина имеет большое значение для токсикологии и фармацевтики.
Исследование выполнено при финансовой поддержке Российского научного фонда, номер проекта 23-73-0106.
Источник: ИФХЭ РАН.