http://93.174.130.82/news/shownews.aspx?id=5ecc6a9e-8c64-4856-b009-a19cbcbdb535&print=1
© 2025 Российская академия наук
Московские
ученые совместно с зарубежными коллегами создали новый биосенсор для наблюдения
за процессами метаболизма в живых организмах. Он обнаруживает сверхнизкие
концентрации пероксида водорода, регулирующего
обмен веществ. Изучать это соединение трудно, ведь его молекулы живут максимум
несколько секунд. Биохимический зонд HyPer7 оказался в 30 раз чувствительнее
и в 80 раз быстрее своих предшественников. О своей
работе биохимики сообщили в журнале Cell Metabolism. Исследования поддержаны грантом Российского
научного фонда.
Перекись
водорода H2О2 — одна из
важнейших молекул в организме живых существ. Она образуется в процессе
метаболизма, а также выделяется специализированными ферментными системами. В
организме это соединение регулирует работу различных биохимических процессов,
но при слишком высоком ее содержании может произойти так называемый
окислительный стресс — избыток активных форм кислорода в организме. Он
участвует в развитии многих заболеваний, таких как воспалительные, онкологические
и нейродегенеративные. Регуляторную функцию молекулы выполняют, находясь в
чрезвычайно низких концентрациях, из-за высокой скорости реакции они живут
максимум несколько секунд. Эти особенности перекиси водорода сильно затрудняют
изучение ее влияния на метаболизм и возникновение патологий.
Разработка
российских ученых — плод многолетней работы над биосенсорами, позволяющими
наблюдать за пероксидом водорода в клетке с помощью оптики, например
микроскопа. Первое поколение отечественных зондов получило мировое признание и
расширило знания ученых в области метаболизма, но имело существенный недостаток
— они не могли обнаружить сверхнизкие концентрации H2О2, с помощью которых реализуется большинство ее функций.
Также результаты наблюдения могли быть неточными из-за того, что работа сенсора
сильно зависела от кислотности среды.
Обычно биосенсоры
— это приборы, которые находят химические соединения с помощью веществ,
реагирующих на эти соединения. Например, биосенсоры используются для измерения
количества сахара или алкоголя в крови. Но биосенсоры, о которых идет речь в
исследовании, являются белковыми молекулами. В основе такого зонда ученые использовали
зеленый флуоресцентный белок GFP, способный поглощать свет и через
несколько наносекунд испускать его обратно с немного увеличенной длиной волны,
то есть «светиться». Такой белок сшивается с другим белком, OxyR, природным
сенсором пероксида водорода. В результате «свечение» (флуоресценция) GFP меняет
свои свойства при взаимодействии зонда с H2О2. OxyR есть почти у всех бактерий. Поскольку исследователи не знали
заранее, какой из белков окажется наиболее чувствительным, то выбрали для
эксперимента 11 OxyR из разных неродственных друг другу видов микроорганизмов. В итоге
сверхчувствительный сенсор получился при сшивании флуоресцентного белка GFP с белком OxyR, содержащимся
в бактерии менингококк Neisseria meningitidis, обитающей в носоглотке человека и вызывающей
менингит и назофарингит. OxyR этой бактерии реагирует на окисление пероксидом водорода, но при
этом нечувствителен к другим активным формам кислорода.
«По-видимому,
менингококк в процессе эволюции выработал сверхчувствительный OxyR, строго избирательный
к пероксиду водорода. Это нужно для того, чтобы заранее чувствовать активацию нейтрофилов
и макрофагов, иммунных клеток организма хозяина, использующих пероксид
водорода, чтобы убить бактерию. В ответ менингококк способен усиливать свои
антиоксидантные системы, защищающие его от окислительного стресса», — рассказывает Всеволод
Белоусов, руководитель проекта по гранту РНФ, доктор
биологических наук, заведующий отделом метаболизма и редокс-биологии ИБХ имени М. М. Шемякина и Ю. А.
Овчинникова РАН, и.о. директора Федерального центра мозга и нейротехнологий
МЗ РФ.
По словам ученого,
новый зонд HyPer7 — настоящий прорыв в сфере биосенсоров: «Мы получили уникальный индикатор
с высокой яркостью и коротким временем отклика, реагирующий на сверхнизкие
концентрации перекиси водорода, при этом не зависящий от кислотной среды. HyPer7 оказался
в 30 раз чувствительнее и в 80 раз быстрее предыдущих версий».
С помощью
сенсора авторам работы уже удалось изучить детали перемещения молекул H2О2 внутри клетки, исследовать роль градиентов пероксида
водорода в движении клеток и при повреждении тканей. Разработка биохимиков
позволит визуализировать перекись водорода в клетках, тканях и органах, и исследовать
роль этой молекулы в нормальных биохимических процессах. Также будет изучена роль
перекиси водорода в возникновении и развитии ишемических, нейродегенеративных,
воспалительных и онкологических заболеваний, которые тесно связаны с
окислительным стрессом. В исследовании российским ученым помогали коллеги из
Бельгии, Франции, Германии и США.

Картинка 1.
Сотрудники отдела метаболизма и редокс-биологии ИБХ РАН в лаборатории. Слева – Валерий
Пак, первый автор статьи.
Источник: из лабораторного архива.

Картинка 2.
Несколько поколений лаборатории молекулярных технологий ИБХ РАН. Встреча 2020
года.
Источник: Дарья Смолярова.
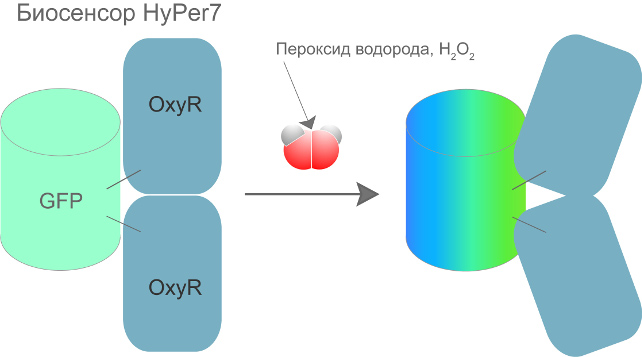
Картинка 3.
Биосенсор HyPer7 состоит из флуоресцентного белка GFP, сшитого с белком OxyR. Источник:
Всеволод Белоусов.
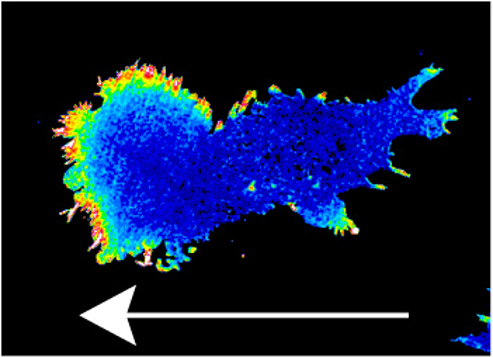
Картинка 4.
Градиент пероксида водорода в клетке задает направление ее движения. Стрелка показывает
направление движения.
Источник: Всеволод Белоусов, модифицировано из
оригинальной публикации.