Исследование реакции нуклеофильного замещения
14.08.2023
Пиримидинфосфорилазы, в частности уридинфосфорилаза (УФаза), являются важными инструментами в биотехнологическом синтезе производных пиримидинов и медицине. Оптимизация процесса биокатализа и создание специфических регуляторов активности УФаз требуют понимания механизма функционирования фермента на структурно-функциональном уровне.
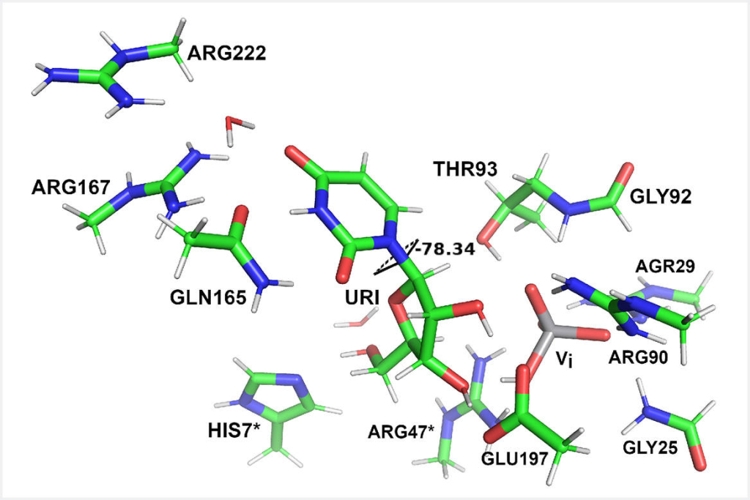
Для исследования каталитических процессов в белках-ферментах на структурно-функциональном уровне используeтся времяразрешающая белковая кристаллография, основанная на серийной кристаллографии и использовании лазеров на свободных электронах. Используя гибридные квантово-механические/молекулярно-механические (КМ/ММ) методы возможно предварительно описать путь ферментативной реакции и рассчитать энергетические характеристики этого процесса и/или его отдельных стадий.
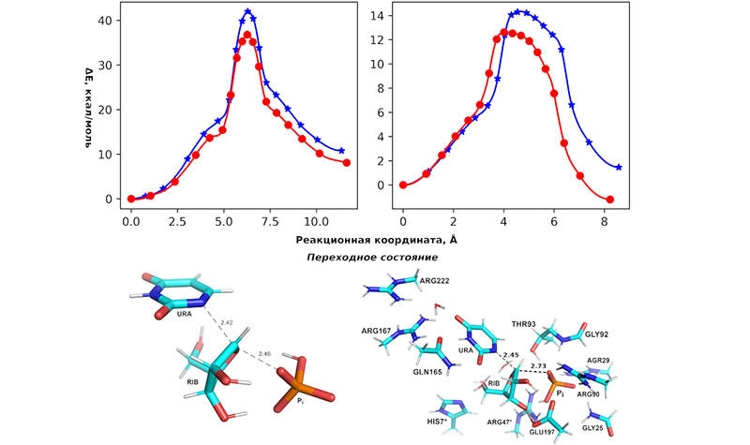
Энергетические профили реакции нуклеофильного замещения (верхние рисунки) и структуры переходного состояния (нижние рисунки).
Учеными Института кристаллографии (ИК) им. А. В. Шубникова РАН ФНИЦ «Кристаллография и фотоника» РАН совместно с коллегами из НИЦ «Курчатовский институт» было проведено сравнение различных уровней теории и схем расчёта точечной энергии, пути минимальной энергии, термохимических характеристик реакции, а также оптимизация геометрии молекул реактантов, продуктов и переходного состояния. По проведенной работе опубликована статья, в которой описывается исследование основной стадии ферментативной реакции фосфоролиза – нуклеофильного замещения азотистого основания в уридине на ортофосфатную или ортованадатную группу, проведенное методами KM/MM.
В сравнении с расчётами активационного барьера, проведёнными в воде без фермента, были выявлены существенные отличия кинетики ферментативной реакции. Они обусловлены ориентирующими и концентрационными действиями аминокислотных остатков белка, что приводит к понижению энергии активации на ~20 ккал/моль и способствует протеканию реакции в физиологически приемлемых условиях.
Также было обнаружено, что свободная энергия активации при нуклеофильной атаке уридина гидрованадат-ионом на ~2 ккал/моль ниже, чем для гидофосфат-иона, что согласуется с литературными экспериментальными данными.
Подробнее в журнале Crystals.
Источник: ФНИЦ «Кристаллография и фотоника» РАН.