Группа сотрудников Института теоретической и экспериментальной биофизики РАН и филиала Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН изучила роль консервативного остатка триптофана в поддержании структуры и активности эндолизинов — ферментов бактериофагов, разрушающих бактериальную клеточную стенку. Эти ферменты перспективны для применения в биомедицине как антибактериальные агенты, а также в биотехнологии, например, используются для выделения ДНК бактерий при секвенировании геномов. Работа опубликована в International Journal of Molecular Sciences.
Эндолизины бактериофагов — ферменты, необходимые для разрушения пептидогликана клеточной стенки бактерий на стадии выхода потомства вируса из клетки. Данный механизм разрушения клеточной стенки до сих пор еще полностью не раскрыт. Учёные из Пущино пытаются объяснить этот механизм и исследуют в своей работе эндолизины бактериофагов T5 и RB49 (EndoT5 и EndoRB49), которые по строению активного центра относятся к семейству М15, подсемейству С. Эти ферменты структурно схожи, и имеют в своем составе ряд консервативных аминокислотных остатков, общих для всех членов подсемейства. Такие остатки сохранились в процессе эволюции потому, что обладали важными особенностями для сохранения функций белков: например, входили в активный центр молекулы или другие регулярные структуры. Среди них особое место занимает консервативный остаток триптофана. Впервые на него обратил внимание д.ф-м.н., профессор Виктор Павлович Кутышенко, внёсший большой вклад в решение трёхмерной структуры эндолизина Т5 методами многомерной ЯМР-спектроскопии. Триптофан, расположен вблизи активного центра белка, но при этом не находится в составе какой-либо регулярной структуры, в результате чего долгое время не привлекал внимания исследователей и даже не входил в число консервативных.
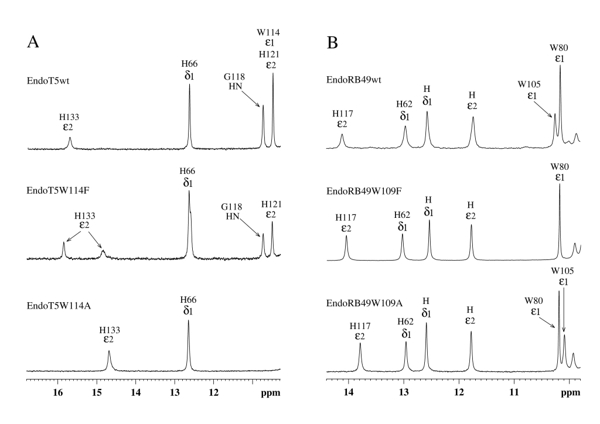
Низкопольные области ароматических частей 1H NMR спектров EndoT5(Zn2+Ca2+) и EndoRB49(Zn2+). (A) EndoT5wt и его мутанты EndoT5W114F и EndoT5W114A. (B) EndoRB49wt и его мутанты Endo RB49W109F и Endo RB49W109A
Коллектив Лаборатории ЯМР-исследований биосистем ИТЭБ РАН совместно с Группой молекулярной биотехнологии Филиала ИБХ РАН попытались установить роль консервативного триптофана. Исследование прокомментировал ведущий научный сотрудник Лаборатории ЯМР-исследований биосистем ИТЭБ РАН, Прохоров Д.А.: «В процессе структурных исследований Ca2+-активируемой эндо пептидазы EndoT5 было обнаружено, что связывание регуляторного иона Ca2+ сопровождается значительными структурными трансформациями фермента, в которые вовлечен также и остаток триптофана, локализованный в Ca2+-связывающей петле. Впоследствии биоинформатический анализ выявил консервативность положения этого остатка в целом подсемействе цинксодержащих пептидаз М15_С. Интересным оказалось и то обстоятельство, что он присутствует как в Ca2+-активируемых пептидазах, подобных EndoT5, так и в ферментах, лишенных такого механизма регуляции, подобных EndoRB49. Поэтому было важно понять причину консервативности остатка, его роль в формировании каталитически активных глобул пептидаз EndoT5 и EndoRB49. С этой целью нами были получены мутантные формы белков, содержащие точечные замены. Одна из замещающих аминокислот (фенилаланин) близка по особенностям к триптофану, а другая (аланин) — радикально от него отличается. Замена всего лишь одного аминокислотного остатка очень сильно повлияла на уровень активности ферментов: фенилаланиновые мутанты обоих белков сохранили около трети от исходной активности, а аланиновый мутант EndoRB49 — всего 5%. EndoT5 с заменой триптофана на аланин был полностью неактивен и имел пониженное сродство к субстрату-пептидогликану. Эти результаты полностью согласуются с тем, что можно увидеть в результате изучения образцов на ЯМР спектрометре: у мутантов нарушена структура как активного центра (о чем свидетельствует сдвиги сигналов HNε2 His 133/117), так и гидрофобного ядра, причем у аланиновых форм эти нарушения выражены значительнее. Изучая спектры макромолекул, можно объяснить и неактивность аланинового мутанта Т5: у него исчезает сигнал, подтверждающий связывание иона кальция».
Авторы впервые показали роль консервативного остатка триптофана в формировании структуры молекул EndoT5 и EndoRB49. Учёные планируют продолжать изучение роли отдельных остатков в формировании активных глобул ферментов. Дальнейшие исследования в этой области могут помочь пролить свет на особенности связывания однодоменных эндолизинов с пептидогликаном бактерий, механизм которого до сих пор не изучен.
Работа поддержана грантом Российского фонда фундаментальных исследований (№ 23-24-00210; Галина Микулинская).
Источник: пресс-служба ИТЭБ РАН.