ЯМР-спектроскопия выявляет закономерности и термодинамические параметры димеризации β-шпилечных антимикробных пептидов в мембране
18.04.2024
Сотрудники Лаборатории структурной биологии ионных каналов и отдела «Учебно-научный центр» Института биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова РАН впервые изучили термодинамику процесса димеризации β-шпилечного пептида в мембраноподобной среде мицелл детергента на примере антимикробного пептида (АМП) капителлацина морской полихеты Capitella teleta и описали механизм его действия на мембраны бактерий.
С помощью ЯМР-спектроскопии были определены структуры двух форм капителлацина в мицеллах — мономер в конформации β-шпильки и димер, образованный путём антипараллельной ассоциации N-концевых β-тяжей пептида. Переходы между этими формами происходили при изменении температуры и соотношения концентраций пептида и детергента. Как оказалось процесс димеризации β-шпилечных пептидов происходит за счет взаимодействия полярных или слабо гидрофобных областей мономеров и зависит в большей степени от межмолекулярных взаимодействий (водородные связи и электростатические и ван-дер-ваальсовые взаимодействия), чем от гидрофобного эффекта. Процесс димеризации характеризуется отрицательным изменением энтальпии и энтропии.
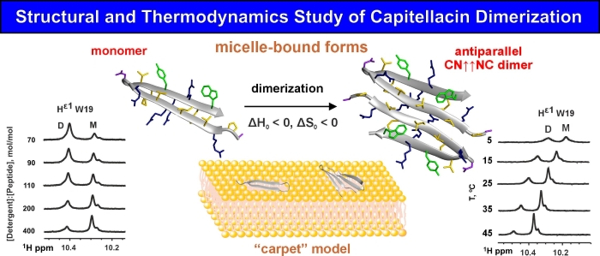
Изучив топологию обеих форм капителлацина в мицелле и распределение полярных и гидрофобных областей на поверхности молекул, авторы пришли к выводу, что мембранолитическое действие капителлацина происходит по «ковровому» механизму. Это объясняет более низкую мембранную, антибактериальную и гемолитическую активности капителлацина по сравнению с другими β-шпилечными пептидами, способными образовывать поры в мембранах клеток.
Сравнение структурных и физико-химических свойств известных β-шпилечных АМП в мономерной и димерной формах выявило положительную корреляцию между стабильностью димерной формы, гемолитической активностью АМП и гидрофобностью его поверхности. Что удивительно, также наблюдалась слабая положительная корреляция между общим зарядом молекулы АМП и гемолитической активностью.
Полученные результаты позволяют более точно описать механизмы фолдинга β-структурных мембранных белков, имеющих структуру β-бочонка, и образования олигомерных трансмембранных пор β-структурными пептидами. Мы надеемся, что изучение взаимосвязи между пространственной структурой и биологической активностью АМП поможет разработать новые антибиотики, так необходимые в современной медицине.
Результаты работы опубликованы в журнале Biomolecules.
Источник: ИБХ РАН.