http://93.174.130.82/news/shownews.aspx?id=3402b463-cb84-4cfa-9bff-f3d1d5675bfc&print=1
© 2025 Российская академия наук
Сделать важный шаг на пути создания лекарства нового
поколения от пост-ковидных осложнений удалось в рамках проекта консорциума
российских химических институтов «Медицинская
химия в создании лекарств нового поколения для лечения социально-значимых
заболеваний». Новые соединения борются с воспалением в организме человека,
при этом не подавляя врожденный иммунитет.
«Когда Минобрнауки был
объявлен конкурс, мы предложили нашим партнерам присоединиться к консорциуму.
Поскольку мы, как головная организация (Институт органического синтеза им. И.
Я. Постовского УрО РАН – Ред.), имели опыт создания противовирусных,
антибактериальных и противоопухолевых препаратов, сотрудничество стало логичным
продолжением совместных исследований», – рассказывает
вице-президент Российской академии наук академик РАН Валерий Чарушин.
По его мнению, итогом
сотрудничества стало создание сразу нескольких перспективных химических
соединений, и одно из них может стать основой для получения нового лекарства от
пост-ковидных осложнений, таких как цитокиновый шторм (вызывается экспрессией
воспалительных цитокинов – Ред.). Его уникальность – отсутствие опасного
побочного эффекта - иммунодепрессирующей активности. «С учетом продолжающейся
пандемии, совместная работа российских ученых
может внести серьезный вклад в борьбу с COVID-19», - подчеркнул Валерий
Чарушин.
Основные
эксперименты с синтезированными уральскими химиками соединениями проводились в
лабораториях Волгоградского государственного медицинского университета
Минздрава России.
«Мы нашли блокаторы
цитокинового шторма, которые практически не подавляют врожденный иммунитет. На сегодняшний день для подавления цитокинового шторма
используется препарат дексаметазон,
но в случае его применения мы одно лечим, а другое – повреждаем. Нередко
следствием снижения иммунитета является возникновение бактериальной инфекции, начинается
пневмония, и больному приходится вводить антибиотики и противовоспалительные
средства.
И хотя наши новые вещества пока уступают
по противовоспалительному действию дексаметазону, зато они не подавляют
иммунитет»,
– поясняет участник проекта, заведующий
кафедрой фармакологии ВолгГМУ академик РАН Александр
Спасов.
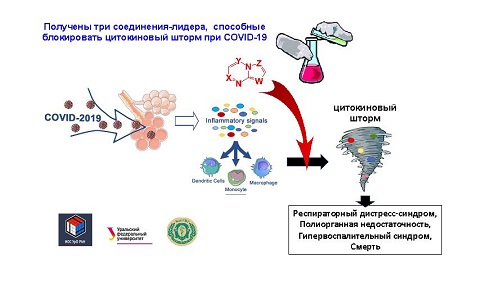
По его словам, вещества уже
проверены на животных. «У животных вызывалось то же состояние, которое бывает
при COVID-19, мы вводили липополисахарид в бронхи и вызывали пневмонит, который
возникает при ковидной инфекции. В крови проверяли про- и противовоспалительные
факторы, смотрели как функционируют бронхи, проводили биохимические
исследования. Выяснили, что наши вещества оказывают позитивный эффект. Мы
выявили три перспективных вещества, одно из них более предпочтительно, но мы
считаем, что надо продолжать поиск», – отмечает
Александр Спасов.
По мнению академика РАН,
преждевременно говорить о том, что найдено вещество, из которого уже завтра
можно будет сделать лекарство. Пока ведутся поисковые исследования. «По крайней
мере, мы нащупали основы тех химических структур, среди которых можно еще
„покопаться” и найти более эффективное вещество, для того чтобы перейти к
полному доклиническому исследованию», – считает
Александр Спасов.
Сплав компетенций
Участниками
проекта стали 8 научных организаций: Институт органического синтеза им. И. Я.
Постовского УрО РАН (ИОС УрО РАН) и Уральский федеральный университет им.
первого Президента России Б.Н. Ельцина (УрФУ) из Екатеринбурга, Институт
органической химии им. Н.Д. Зелинского РАН (ИОХ РАН) из Москвы, Институт
физиологически активных веществ РАН (ИФАВ РАН) и Институт проблем химической
физики РАН (ИПХФ РАН) из Черноголовки Московской области, Институт органической
и физической химии им. А. Е. Арбузова (ИОФХ) из Казани, Новосибирский институт
органической химии им. Н. Н. Ворожцова СО РАН (НИОХ СО РАН) и Волгоградский
государственный медицинский университет Минздрава России (ВолгГМУ).
«В рамках консорциума
переплелись основные достижения ведущих российских научных школ в области
медицинской химии, в каждой из которых накоплены свои традиции, свои классы
соединений. Это позволило добиться успехов в решении трех важнейших задач
проекта: создания препаратов для лечения инфекционных болезней,
противоопухолевой терапии, средств
борьбы с нейродегенеративными заболеваниями», – отмечает Валерий Чарушин.
В области нейродегенеративных
заболеваний (к ним относятся деменция, боковой амиотрофический склероз, болезни
Альцгеймера, Паркинсона и Хантингтона – Ред.), важная роль в консорциуме принадлежит
Институту физиологически активных веществ РАН. «Для уральской школы это
сравнительно новое направление, но в рамках консорциума исследования ведутся в
ряде институтов. Статистика подтверждает актуальность этой темы: в РФ число
пациентов с различными формами деменции приближается
к 2 млн, что составляет заметную часть трудоспособного населения старшего
возраста (> 55 лет)», - говорит
Валерий Чарушин.
На сегодняшний день ключевой
задачей является создание соединений, способных одновременно действовать на
целую группу патологических процессов, участвующих в развитии таких сложных
заболеваний как болезнь Альцгеймера или боковой амиотрофический склероз. В медицинской
химии такой подход получил название «мультитаргетный»,
т.к. потенциальные лекарства действуют сразу на несколько биологических мишеней
(англ. target), и при этом отмечается более выраженный эффект от
препарата.
Исследования по созданию
оригинальных структур, содержащих несколько биологически активных фрагментов, в
Институте физиологически активных веществ РАН ведутся более 20 лет. «В каждом
лекарстве всегда есть определенная структурная группа, которая отвечает за
проявление его лекарственного действия. И вот мы пытаемся соединить эти
фармакологически активные структуры (так называемые фармакофоры) в одну
молекулу, чтобы обеспечить комплексное действие на развитие заболевания», – рассказывает Сергей Бачурин.
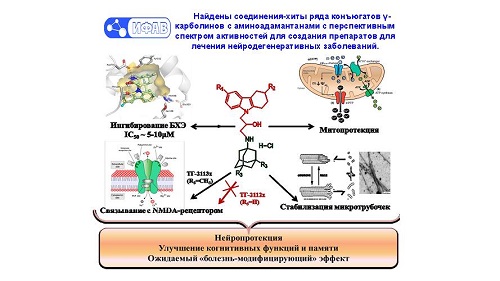
В рамках совместного проекта
были найдены конкретные структуры, которые стабилизируют митохондриальные
функции. «В каждой клетке есть митохондрия – это энергетическая машина клетки,
которая позволяет ей функционировать. При развитии нейродегенеративных
заболеваний именно там в первую очередь происходят нарушения, приводящие к
гибели нервной клетки. Мы получили новые соединения, которые, с одной стороны,
стабилизируют работу митохондрии, а с другой – воздействуют на группу
белков-рецепторов, которые участвуют в формировании памяти. Таким образом, мы,
с одной стороны, защищаем клетки от дальнейшего развития дегенеративного
процесса, а с другой – улучшаем ответ клеток на нервные импульсы и стимулируем
восстановление памяти», – поясняет Сергей Бачурин.
На сегодняшний день эти соединения защищены патентами. «Часть наработок мы
планируем развивать с Федеральным медико-биологическим агентством (ФМБА). Уже
есть несколько соединений-лидеров, по которым успешно завершены доклинические
исследования», – добавляет Сергей Бачурин.
Открытия в области лечения и
профилактики нейродегенеративных заболеваний были сделаны и представителями
новосибирской школы химиков. В частности, научным коллективом НИОХ в
экспериментах in vitro и in
vivo выявлено соединение-лидер, значительно превосходящее по активности проттремин
– препарат для лечения болезни Паркинсона.
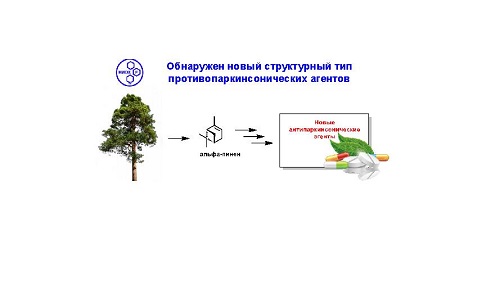
Адресная терапия
Учеными
Института органической и физической химии им. А.Е. Арбузова (Казань) был разработан
подход к получению новых веществ для адресной доставки противоопухолевых
препаратов, а исследователями ИОС УрО РАН (профессор В.П. Краснов)
синтезирована серия новых нанокомпозитов на основе магнитных наночастиц Fe3O4 с оригинальным органическим покрытием. Новые
материалы обладают выраженными магнитными свойствами и оптимальной структурой
поверхности, позволяющей адсорбировать на ней противоопухолевый препарат
доксорубицин и эффективно доставлять его в раковые клетки (разработки на базе ИОС).
«Полученные данные могут быть использованы для создания средств
магнитно-опосредованной химиотерапии рака с возможностью визуализации их
распределения в организме методом МРТ», – выделяет еще один результат совместной
работы Валерий Чарушин.
Исследователям Института
органической химии им. Н. Д. Зелинского РАН удалось выявить эффективный
стимулятор кроветворения, способствующий восстановлению всех основных типов
клеток крови в условиях проведения химио- и лучевой терапии, а также бивалентный
ингибитор (от лат. inhibere «задерживать») ключевых путей метаболизма глюкозы, который
в условиях аэробного гликолиза препятствует выживанию и бесконтрольному
размножению опухолевых клеток. «Открытие найденного нами класса стимуляторов
кроветворения («гемопоэза») является действительно принципиально важным, – уточняет член-корреспондент РАН Николай Нифантьев. – Дело в том, что
при спасении пациентов, проходящих тяжелые виды терапии, особенно при
онкологических заболеваниях, необходимо восстановление лейкоцитов, тромбоцитов
и эритроцитов, то есть трех основных типов клеток крови, а не только лейкоцитов. Таким образом, мы нацелены на создание очень
востребованного лекарства».
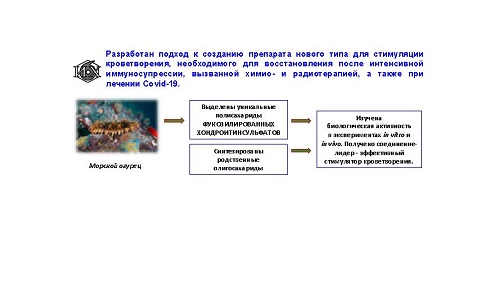
В ходе экспериментов на
разных площадках участвующих в проекте институтов оказалось, что найденные
соединения обладают значительно более широким спектром полезных свойств, чем
предполагалось на начальном этапе. «Исследования на клетках и лабораторных
животных, проведенные участниками работ на базе НМИЦ Онкологии им. Н.Н.Блохина,
показали, что изначально синтезированные стимуляторы кроветворения проявляют
еще и антикоагулянтную (греч.anti - против, лат. coagulatio - свертываемость),
антитромботическую и противовоспалительную активности. Спектр полезных свойств
веществ востребован и для поддерживающей терапии пациентов, оказавшихся в
реанимационных отделениях после операций, при лечении онкологических, инфекционных
и других серьезных заболеваний. Очень важно, что в работах ИОС УрО РАН, ВолгГМУ
и ИОХ РАН мы вышли на такие важные и взаимодополняющие по профилю активности
лекарственные соединения. Это ещё раз показывает продуктивность нашего проекта
в целом», – добавляет Николай Нифантьев.
В результате сотрудничества
УрФУ с ВолгГМУ удалось получить и неожиданный – незапланированный результат. «В
результате совместной работы УрФУ (член-корреспондент РАН В.Л. Русинов) и
ВолгГМУ (академик РАН А.А. Спасов) удалось создать препарат АВ-19 для борьбы с сахарным диабетом второго
типа. Сегодня по этому препарату получен уже третий патент, закончены доклинические
исследования, в Минздрав РФ представлены документы для получения разрешения на
проведение клинических испытаний», – говорит
Валерий Чарушин.
В
целом по результатам реализации проекта получено два патента РФ и подано две заявки
на выдачу патентов РФ по трем ключевым заявленным направлениям, опубликовано 12
статей в авторитетных международных журналах: Medicinal Research Reviews, Pharmaceuticals,
ChemMedChem, Molecules, Scientific Reports, Inorganica Chimica Acta, Journal of Physical Chemistry A, Tetrahedron, Mendeleev Communications.
«Пожалуй,
самый важный результат проекта – возможность использовать лучшие разработки
российских химиков, а также оборудование и инфраструктуру научных институтов –
участников консорциума для коллективной работы, создания лекарств нового
поколения», - подводит итоги Валерий Чарушин.
Проект «Медицинская химия в создании лекарств нового
поколения для лечения социально-значимых заболеваний» реализован в 2021 году
при поддержке Минобрнауки РФ (Соглашение № 075-15-2020-777 от 01.10.2020).