http://93.174.130.82/news/shownews.aspx?id=1bf29ee1-6537-4645-b43a-b7a1024eb6e8&print=1
© 2025 Российская академия наук
С развитием современных экспериментальных методик и
эффективных инструментов детектирования начался новый виток в изучении болезни
Альцгеймера. На сегодняшний день это тяжелое нейродегенеративное заболевание
является актуальной проблемой во всем мире. Болезнь Альцгеймера называют самой
распространенной формой деменции, поражающей людей престарелого возраста. В
настоящее время нет эффективных препаратов от этого заболевания. Любое лечение
практически невозможно ввиду постановки диагноза на поздних стадиях, а также отсутствия
однозначного понимания этиологии болезни. В связи с этим исследования
фундаментальных механизмов возникновения болезни Альцгеймера приобретают
большое значение.
С 2019 года ученые ОИЯИ ведут работу по
изучению свойств клеточных мембран и клеточных взаимодействий, взяв за основу
одну из наиболее распространенных теорий возникновения болезни Альцгеймера –
бета-амилоидную. Данная теория основывается на том факте, что в мозге пациента,
страдающего болезнью Альцгеймера, бета-амилоидный пептид может образовывать так
называемые амилоидные бляшки, состоящие из скоплений пептида, свернутого в виде
фибрилл, что в конечном итоге приводит к разрушению клеточных мембран и гибели
нейронов.

Группа ученых ОИЯИ, проводивших
исследования.
Изначально группа была нацелена на исследование
«поведения» бета-амилоидного пептида, встроенного в мембрану, в зависимости от
ее жесткости. При этом использовалась низкая концентрация бета-амилоидного
пептида для предотвращения формирования фибрилл. В ходе исследований, которые
группа провела в 2019–2020 годах, было выяснено, что жесткостью клеточной
липидной мембраны может управлять холестерин и мелатонин.
«Присутствие холестерина вызвало
заметное увеличение толщины модельной мембраны: холестерин упорядочил
углеводородные хвосты липидов и удлинил их, что увеличило толщину и повысило
вязкость мембраны, – рассказывает заместитель директора Лаборатории нейтронной
физики по научной работе, руководитель научной группы Норберт Кучерка.
– Эффект влияния мелатонина, уменьшающего толщину мембраны и понижающего ее
вязкость, связан с разупорядочением липидных хвостов: молекулы мелатонина
локализовались в области фосфолипидных голов и привели к увеличению расстояния
между ними».
В ходе опытов с холестерином и мелатонином ученые
заметили, что температура оказывает влияние на структуру модельной мембраны в
присутствии бета-амилоидного пептида, а именно на униламеллярные везикулы,
представляющие собой сферическую оболочку, состоящую из липидного бислоя.
Результаты следующего этапа исследования, основанные на данных эксперимента,
проведенного уже в 2021 году, подтвердили данное наблюдение и позволили
обнаружить интересный эффект: при понижении температуры и переходе липидов, из
которых состоит модельная мембрана, в гелевую фазу наблюдалось «разрушение»
мембраны – распад везикул на бицеллоподобные структуры (плоские дискообразные
структуры из одного бислоя липидов), но только в присутствии амилоид-бета
пептида. В отсутствие пептида мембрана сохраняла целостность.
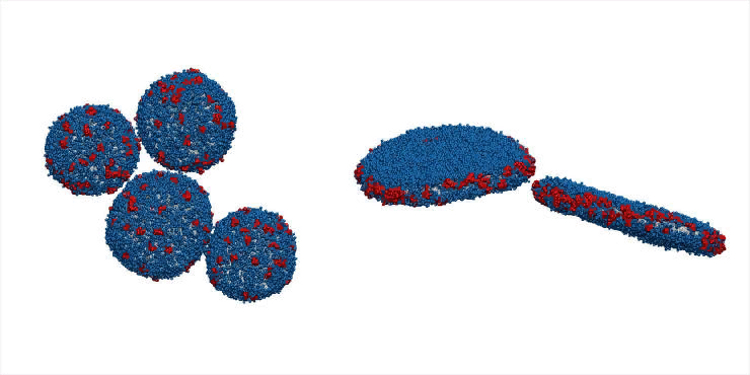
Самоорганизующиеся структуры маленьких
однослойных везикул и дисков после моделирования. Липидные цепи представлены
серым цветом, головные группы липидов – синим, а молекулы Aβ(25-35) – красным.
Молекулы воды не показаны для лучшей визуализации.
Проделанная в рамках исследования работа была высоко
оценена и получила вторую премию ОИЯИ в категории научно-технических прикладных
работ за 2022 год.
«Изменения физико-химических свойств
клеточной мембраны в результате фазового перехода сами по себе не приводят к ее
разрушению. Тем не менее, взаимодействие с дополнительными компонентами может
приводить к резким структурным изменениям. В своем исследовании мы
документально подтвердили, что такие изменения, вызванные присутствием
бета-амилоидного пептида, происходят во время фазовых переходов. Мы
использовали метод малоуглового рассеяния нейтронов на реакторе ИБР-2 ЛНФ ОИЯИ,
идеально подходящий для исследования таких разупорядоченных систем, как
липидные мембраны, поскольку методы, основанные на кристаллографии, в таких
случаях не срабатывают. Кривые малоуглового рассеяния нейтронов продемонстрировали
деструктивное влияние бета-амилоидного пептида на модельную мембранную систему.
Под влиянием температуры и в присутствии пептида форма модельной системы
изменяется от больших везикул до везикул малого размера и бицеллоподобных
структур», – сообщил один из авторов работы, старший научный сотрудник ЛНФ
ОИЯИ Александр Иваньков.
Наблюдаемый эффект фрагментации пептидом мембраны
может быть ключевым моментом в понимании роли мембранно-пептидных
взаимодействий при болезни Альцгеймера, отмечают ученые.
«Теперь нам нужно понять, как и почему
это происходит. А когда найдем механизм в нашей простой модельной системе,
будем усложнять ее, изучать различные теории, проверять их. Наши исследования,
по сути, фундаментального уровня, то есть наши результаты не имеют
непосредственного применения, однако у них есть потенциал, чтобы стать
прикладными и применяться в фармакологии и областях, связанных со здоровьем
человека», – подытожил Норберт Кучерка.
Источник: Объединенный институт ядерных исследований.