Учёные проанализировали исследования,
посвященные нейродегенеративным заболеваниям, таким как болезнь Альцгеймера,
Хантингтона и деменция с тельцами Леви, и выяснили, какую роль в них играют три
белка ПИДДосомного комплекса, запускающего процесс программируемой гибели
клеток. Так, мутации в двух из них — PIDD1 и RAIDD — приводят к аномалиям в
развитии мозга, а избыток третьего — каспазы-2 — способствует появлению
патологических белков в нервной ткани. Работа может использоваться при создании
новых лекарственных препаратов для лечения нейродегенеративных заболеваний.
Результаты исследования, поддержанного грантом
Президентской программы Российского научного фонда (РНФ), опубликованы в
журнале Trends in Molecular Medicine.
Клетки нашего организма постоянно обновляются: одни
умирают, другие появляются. Один из наиболее изученных вариантов клеточной
гибели — апоптоз. Это программируемый процесс, который предотвращает
размножение в организме клеток с какими-либо нарушениями. Так, если клетка
неправильно функционирует, в ней запускается «самоуничтожение», которое
регулируют особые ферменты, называемые каспазами. Интересно, что инициирующие
апоптоз каспазы работают не поодиночке, а в комплексах с белками-помощниками.
Например, каспаза-2 формирует с белками PIDD1 и RAIDD комплекс под названием
ПИДДосома, который, собственно, и участвует в запуске апоптоза. Однако
исследования указывают на то, что ПИДДосома может работать не
только во благо организма, но и в определенных случаях приводить к
нейропатологиям.
Сотрудники Института молекулярной биологии
имени В. А. Энгельгардта (Москва) и Московского государственного
университета имени М. В. Ломоносова проанализировали исследовательские
работы, в которых была установлена связь между компонентами ПИДДосомы и
развитием нейродегенеративных заболеваний, чтобы лучше понять, какую роль эти
белки играют в появлении нарушений.
«Нейродегенеративные заболевания
представляют собой различные патологии, характеризующиеся дисфункцией и
продолжающейся потерей нейронов, глиальных клеток и нейронных сетей в головном
и спинном мозге, что вызывает определенные проблемы, связанные с движением,
памятью и способностью человека говорить и дышать. Болезни Альцгеймера,
Хантингтона и деменция с тельцами Леви — одни из самых ярких примеров таких
патологий. Современные методы лечения имеют ограниченную эффективность и
помогают лишь замедлить их прогрессирование», — рассказывает
участник проекта, поддержанного грантом РНФ, ведущий автор статьи, Алексей
Замараев, научный сотрудник Института молекулярной биологии имени В. А.
Энгельгардта и Лаборатории исследования механизмов апоптоза МГУ имени М. В.
Ломоносова.
Анализ имеющихся данных показал, что мутации в
генах, кодирующих белки PIDD1 и RAIDD, зачастую приводят к аномалиям развития
мозга, в частности, к сглаживанию извилин коры больших полушарий. Это, в свою
очередь, выражается в умственной отсталости, проблемах с психикой и поведением.
Другие работы указали на
то, что избыток каспазы-2 в головном мозге приводит к накоплению специфических
белков-амилоидов, которые служат маркерами указанных выше нейродегенеративных
заболеваний.
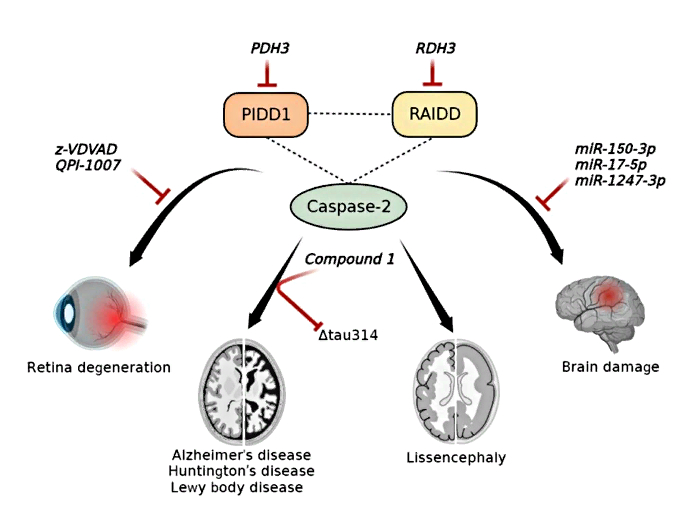
Ингибирование компонентов ПИДДосомы как метод борьбы
с нейродегенеративными заболеваниями
Таким образом, компоненты ПИДДосомы могут служить
многообещающей терапевтической мишенью для лечения нейродегенеративных
заболеваний и других поражений головного мозга. Более того, авторы описали
реальные примеры, когда белки ПИДДосомы использовались для этих целей. Так,
эксперименты на мышах показали, что подавление активности каспазы-2 помогает
восстановить память и когнитивные функции животных, страдающих от болезней
Альцгеймера, Хантингтона и деменции с тельцами Леви.
«Лабораторные исследования уже позволили
найти ряд соединений, которые, воздействуя на различные компоненты ПИДДосомы,
помогают бороться с признаками нейродегенеративных заболеваний. Последующие
доклинические и клинические испытания помогут лучше оценить их эффективность и,
возможно, ввести их в клиническую практику», — подвел итог
участник проекта, поддержанного грантом РНФ, Павел Волик, аспирант кафедры
биохимии и регенеративной биомедицины МГУ имени М. В. Ломоносова и лаборант
Института молекулярной биологии имени В. А. Энгельгардта.
В дальнейшем авторам предстоит более подробно
изучить, влияют ли мутации в PIDD1 и RAIDD на сборку ПИДДосомы и как именно они
приводят к нарушениям развития головного мозга.
Источник: РНФ.