http://93.174.130.82/news/shownews.aspx?id=0824e8f3-a34c-4ede-a620-5082e9c94d2a&print=1
© 2025 Российская академия наук
Проблема возникновения раковых
новообразований относится к одной из нерешённых проблем биологии и медицины. В
Институте теоретической и экспериментальной биофизики РАН (ИТЭБ РАН) проведено
исследование для проверки гипотезы о сохраняющейся способности различных
специализированных клеток млекопитающих защищать себя от летальных повреждений
путем реактивации защитного атавистического механизма клеточной пластичности. Результаты
исследования опубликованы в журнале «Биофизика».
Известно, что раковый процесс можно индуцировать с
помощью различных повреждающих воздействий, вызванных хроническим действием
химических канцерогенов, радиацией, УФ-светом, бактериальными и вирусными
инфекциями. Какой патогенетический механизм объединяет столь разные воздействия
и одновременно повышает риск возникновения раковых заболеваний?
Чтобы ответить на этот вопрос, ведущий научный
сотрудник ИТЭБ РАН доктор биологических наук Полина
Шварцбурд предложила и проверила гипотезу о сохраняющейся способности
различных специализированных клеток млекопитающих защищать себя от летальных
повреждений путём реактивации защитного атавистического механизма клеточной
пластичности.
Схема, показывающая как раковый процесс можно
индуцировать с помощью различных повреждающих воздействий, вызванных
хроническим действием канцерогенов, радиаций, УФ-светом, бактериальными и
вирусными инфекциями
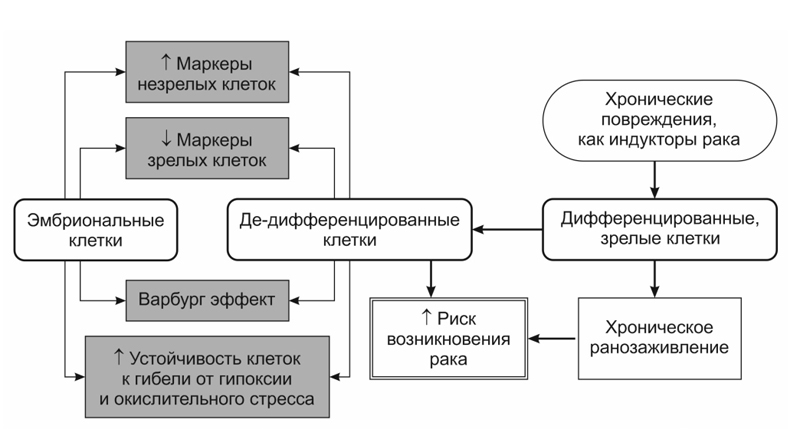
Пластичность клеток играет ключевую роль в репарации
тканевых повреждений, позволяя клеткам восстановить утраченные структуры и
функции поврежденного органа или ткани. Развитие такой защиты сопровождается временным
изменением метаболизма, в частности переходом дифференцированных клеток от
энергозатратного кислород-зависимого метаболизма к энергосберегающему
кислород-независимому гликолизу (Варбург метаболизму). Такой метаболический
переход повышает порог устойчивости клеток к гибели при различных
рак-индуцирующих повреждающих воздействиях, но при этом понижает уровень
дифференцировки клеток, индуцируя возвращение клеток из специализированного
состояния в предшествующее, незрелое эмбрионально-подобное состояние.
Однако программы регенерации у эмбриона и взрослого
организма значительно отличаются. Ключевые различия между этими программами, в
первую очередь, относятся к воспалительному процессу, который отсутствует в
эмбриональных и опухолевых тканях, но индуцируется в зрелых тканях при
хронических повреждениях, формируя тем самым локальные зоны со свойствами
«незаживающей раны».
Именно в таких локальных очагах хронического
воспаления накапливаются незрелые эмбрионально-подобные клетки и появляются
первичные очаги опухолевого роста, что хорошо известно из многочисленных
клинических наблюдений.
Предположенная гипотеза объясняет эти наблюдения,
рассматривая восстановление ткани в ответ на повреждение как сложный
скоординированный процесс, который во взрослом, стареющем организме идёт по
хроническому воспалительному пути, не наблюдаемому в период эмбриогенеза.
Эти различия обусловлены критической ролью
микроокружения, без которого реализация регенераторного потенциала
де-дифференцированных клеток в условиях хронического воспаления становится
маловероятной. В результате, повышается риск появления раковых клеток
именно в зонах локального хронического воспаления.
Несмотря на пробелы в знаниях, имеется ряд факторов,
из которых начинает складываться общая картина путей инициации
развития онкозаболеваний, как части атавистической программы самозащиты зрелых
клеток от повреждений. Изучение роли этого защитного механизма должно дать в
будущем новые возможности для лучшего понимания и предупреждения развития
раковых заболеваний.
Текст: Алсу Дюкина.
Источник: пресс-служба ИТЭБ РАН.