http://93.174.130.82/news/shownews.aspx?id=017d3a9d-cd71-48b7-9c18-9dc53f897632&print=1
© 2025 Российская академия наук
Ученые федерального исследовательского
центра «Фундаментальные основы биотехнологии» Российской академии наук
составили всесторонний обзор свойств дрожжевых прионов – особых белковых
структур, способных стабильно размножаться и наследоваться в ряду поколений
дрожжей.
Прионы этих микроскопических грибов широко
используются как модель для изучения нейродегенеративных заболеваний, поскольку
в организме человека подобные структуры приводят к развитию заболеваний, таких
как, например, болезни Альцгеймера и Паркинсона. Знание свойств прионов поможет
разработать лекарства от нейродегенеративных заболеваний и замедлить их
развитие у пожилых людей. Исследование проведено при поддержке национального
проекта «Наука и университеты».
Иногда белки человека и животных теряют свою
нормальную укладку и образуют специфические нитевидные агрегаты, или фибриллы,
называемые амилоидами. Эти структуры способны запускать «цепную реакцию»,
присоединяя к себе все новые и новые молекулы нормальной формы того же белка,
изменяя его укладку на себе подобную. Это позволяет амилоидам расти,
размножаться и распространяться в пределах организма, вызывая неизлечимые
заболевания – амилоидозы, среди которых у человека наиболее распространены
болезни Альцгеймера и Паркинсона. На сегодняшний день от них страдают десятки
миллионов людей во всем мире, и это число быстро растет по мере старения
человечества, что представляет существенный вызов для мирового здравоохранения.
Кроме того, некоторые амилоиды способны даже заражать других людей или
животных, поэтому им дали собственное название – прионы, или инфекционные
белки. С прионами связывают группу сравнительно редких, хотя и достаточно известных
заболеваний, таких как болезнь Крейцфельдта–Якоба, куру, коровье бешенство и
скрейпи овец.
Однако не для всех живых организмов прионы вредны.
Так, у дрожжей – одноклеточных микроскопических грибов – прионы не несут
значительного вреда клетке, а иногда даже могут быть полезны, увеличивая ее
устойчивость к неблагоприятным условиям окружающей среды. Изучение прионов и
амилоидов на животных моделях – длительный, трудоемкий и даже опасный процесс,
из-за чего он требует высокого уровня лабораторной защиты. Прионы дрожжей не
имеют этих недостатков и потому являются удобной моделью для ученых. Данные,
полученные с их помощью, можно использовать для разработки лекарств от
нейродегенеративных заболеваний.
Ученые из федерального исследовательского центра
«Фундаментальные основы биотехнологии» Российской академии наук (Москва)
проанализировали множество работ, изучающих свойства прионов дрожжей, и
обобщили их результаты в виде обзора. В нем авторы постарались дать максимально
полную картину молекулярного устройства данных белков и механизмов их
взаимодействия с клеткой.
Так, в статье подробно описан наиболее изученный
прион дрожжей – Sup35, который участвует в контроле синтеза белков. Если в
геноме микроорганизма случайно возникает мутация, преждевременно завершающая
синтез белка, прион Sup35 позволяет преодолеть это нарушение. Например, дрожжи
с мутацией гена ade1-14 не способны синтезировать аденин из-за того, что этот
процесс прерывается в определенном месте, соответствующем мутации в гене. Это
приводит к накоплению промежуточного продукта – пигмента, который придает
красный цвет колониям дрожжей. Однако, если в клетке есть прион Sup35, он
помогает «преодолеть» мутацию ade1-14 и довести синтез аденина до конца. В
результате окрашенный продукт не накапливается и цвет колоний меняется на белый
или различные оттенки розового, в зависимости от «силы» приона.
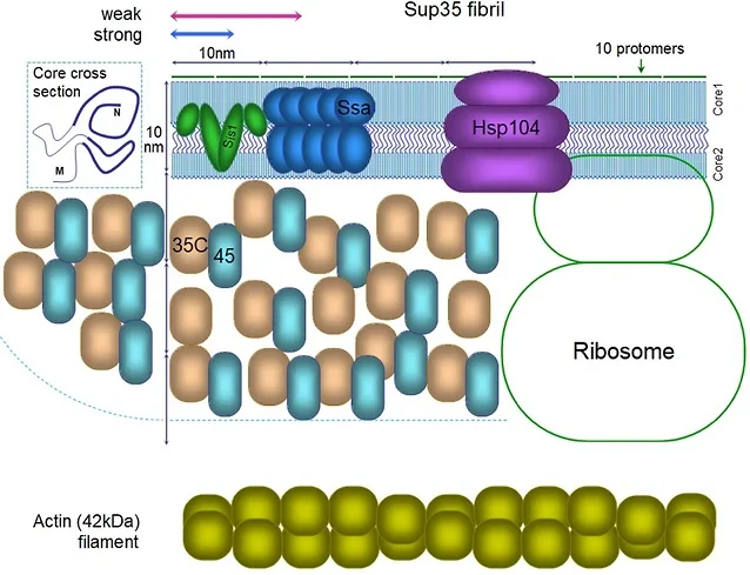
Схематическая структура прионной
фибриллы и связанных с ней белков. Источник: mdpi.com.
В обзоре авторы наглядно представляют структуру
приона Sup35 и белков, взаимодействующих с ним. Вероятно, впервые такой рисунок
удалось представить с соблюдением всех молекулярных пропорций. Он позволил
исследователям продемонстрировать уникальную особенность амилоидов: очень
плотную упаковку белковых молекул в амилоидной фибрилле. Так, одна белковая
молекула в составе амилоида занимает в 11 раз меньшее пространство по длине
фибриллы, чем молекула актина в пучке мышечных волокон. В связи с этим на
рисунке удалось разместить лишь малую долю от количества молекул,
взаимодействующих с прионом Sup35. Столь плотная упаковка должна накладывать
ограничения на взаимодействие амилоида с другими молекулами, в частности, с
белками-шаперонами, которые пытаются «бороться» с прионами, растворяя их.
Весьма любопытно, что эта борьба обычно дает
противоположный результат, помогая прионам размножаться. Интересное свойство
прионов дрожжей, как и всех амилоидов, состоит в том, что, если из этой плотной
структуры извлечь всего одну входящую в нее белковую молекулу, что делает
шаперон Hsp104, прион распадется на две части. При этом оба получившихся
фрагмента остаются способными «заражать» нормальные белки. Именно так и
происходит размножение прионных частиц. Применительно к дрожжам этот процесс
необходим для того, чтобы прионы в равной мере доставались при делении дочерним
клеткам. В организме человека разделение прионов и амилоидов на более мелкие и
более мобильные фрагменты позволяет им легче распространяться в пределах
организма. Также множество данных говорит о том, что они более токсичны.
Прионные белки дрожжей обычно содержат две части.
Одна из них, сравнительно небольшая, образует амилоидный стержень приона.
Другая отвечает за функцию белка, и эта функция уменьшается или модифицируется,
когда нормальный белок превращается в прион. Многочисленные исследования
показали, что, когда эта функциональная область находится в самом начале или в
конце белка, ее переход в прионную форму происходит более охотно.
Но авторы обзора обнаружили еще более яркое явление:
если из-за мутации синтез белка преждевременно завершается сразу после
прионогенной области, помещая ее на конец белка, то частота первичного
появления приона возрастает в 6000 раз. Это наблюдение подкрепляет и
детализирует одну из популярных гипотез появления амилоидов у человека в
результате соматических мутаций. И расчеты показывают, что число клеток с
такими мутациями, которые могут быть очагами возникновения амилоидоза, в
организме каждого человека исчисляется миллионами.
Виталий Кушниров,
доктор биологических наук, ведущий научный сотрудник лаборатории молекулярной
генетики федерального исследовательского центра «Фундаментальные основы
биотехнологии» РАН, ответил на вопросы «Ъ-Науки»:
– С какими болезнями связан
механизм работы прионов?
– Прионы являются малой частью более
широкого явления, амилоидов. Амилоиды встречаются гораздо чаще, но слово
«прион» у всех на слуху. Вероятно, это связано с удивительным свойством прионов
являться инфекцией, не имея какой-либо генетической программы в виде ДНК или
РНК, как у всех прочих инфекционных агентов, вирусов, бактерий,
микроорганизмов. Но различия прионов и амилоидов сугубо количественные.
Инфекционность прионов связана с их способностью катализировать структурное
превращение такого же, но растворимого белка, и расти, присоединяя его к себе.
Это свойство характерно и для амилоидов.
У человека известно более сорока белков,
способных образовывать патологические амилоиды. Соответствующие болезни,
амилоидозы, возникают обычно в зрелом возрасте, и на данный момент не
существует способов их лечения. Наиболее известны из них болезни Альцгеймера и
Паркинсона, и многие амилоидозы проявляются в нарушении работы мозга. Но также
амилоиды являются причиной диабета второго типа, а в некоторых случаях они
могут быть как причиной, так и следствием рака. Все «прионные» болезни человека
связаны с одним лишь белком – PrP. Тем не менее они могут иметь разные
проявления и называться по-разному. Так, болезнь куру связана с ритуальным
каннибализмом у племен Новой Гвинеи, а болезнь Крейцфельдта–Якоба возникает
спонтанно. Также отмечу, что существуют непатологические, полезные амилоиды, и
один из них играет ключевую роль в долговременной памяти.
– Насколько структура дрожжевых
прионов похожа на подобные структуры в организме человека?
– Хотя амилоиды могут быть образованы
очень разными белками, их структуры довольно похожи. В каждой белковой
молекуле, составляющей амилоид, можно выделить две части. Одна часть образует
стержень амилоида. При образовании амилоида она максимально «сплющивается»,
можно сказать, в листочек, перпендикулярно оси амилоидной фибриллы. Такая
большая стопочка листочков. Другая часть свободно прикреплена к оси, образуя
подобие шубы. Эта «шуба» составляет одно из отличий. В дрожжевых прионах она
присутствует всегда, а в человеческих амилоидах часто отсутствует. Наличие
«шубы» важно для взаимодействия амилоида с клеткой, с другими белками. Но, в
конце концов, нетрудно сделать дрожжевой прион без «шубы». Так что можно
сказать, что дрожжевые прионы отличаются от человеческих амилоидов не более,
чем человеческие отличаются между собой. Достаточно распространено и изучение
человеческих амилоидных белков в дрожжах.
Существенная разница в другом: в дрожжах
можно изучать «жизнь» амилоида и способы избавиться от него, но нельзя изучать
эффекты амилоида на человеческий организм. Лучшим лечением амилоидоза было бы
избавление от амилоида. Такие попытки делались в том числе на основе идей,
выработанных в дрожжевой системе. Пока безуспешно. Лекарства, имеющиеся в
настоящее время, выработаны на животных моделях. Они могут смягчить негативные
эффекты амилоидов, воздействуя на нервные клетки. Но они не устраняют основу
болезни, амилоид, что в конце концов приводит к гибели.
– Расскажите подробнее о том,
как можно использовать полученные в ходе исследования результаты для лечения
людей?
– Борьба с амилоидами имеет глубинную,
концептуальную сложность. Чтобы победить бактерии, человек нашел в природе
оружие – антибиотики, вырабатываемые грибами. Но похоже, что природа не
особенно пыталась бороться с амилоидами и оружия против них не запасла.
Сейчас наука в стадии поиска
инструментов для лечения амилоидозов, которые затем можно было бы
совершенствовать. В частности, в такой роли пробовали белок дрожжей Hsp104,
мощную молекулярную машину, которая способна разбирать прионы. Hsp104 есть у
дрожжей, но не у животных и человека. Однако в результате разборки образуются
более мелкие кусочки амилоида, способные к самостоятельному росту, что во
многих случаях нивелирует работу Hsp104. Наверное, более эффективным подходом
был бы поиск молекул, блокирующих рост амилоида. Небольшие изменения в молекуле
белка, составляющего амилоид, могли бы позволять ей встраиваться в амилоид и
блокировать его дальнейший рост. Такие исследования ведутся, но и здесь не все
просто. В целом же дрожжи помогли быстрее и лучше понять, как устроены амилоиды
и как они взаимодействуют с клетками. И это, несомненно, облегчает и ускоряет
поиски лекарств и подходов к борьбе с амилоидозами.
Использованы материалы статьи.
Источник: Коммерсантъ.